8.15.Contracción de volumen en una disolución
En el momento de disolver una sustancia en otra (normalmente se usan los términos soluto y disolvente...) se produce un fenómeno de reorganización molecular que origina un cambio de volumen de tal manera que la suma de los volúmenes de las sustancias por separado no tiene necesariamente que coincidir con el volumen total de la disolución.
Todo depende de las fuerzas (en módulo y orientación) de las interacciones soluto-soluto, disolvente-disolvente y soluto-disolvente. Según cuales prevalezcan, el volumen resultante de la disolución será mayor (poco frecuente) o menor (más frecuente) que la suma de los volúmenes por separado. Dado que este segundo caso es el más frecuente, suele hablarse de este fenómeno como el de una "contracción de volumen", aunque en algún caso pueda darse el aumento del mismo.
La pregunta que intentamos contestar aquí es si esa contracción de volumen es significativa en el orden de magnitud de concentraciones en el que se mueve la elaboración de cerveza. Pretendemos ver tres casos que, de una manera u otra, aparecen en el mundo cervecero: disolución de etanol en agua, disolución de Sacarosa en agua y disolución de Dextrosa en agua.
|
|
|
8.15.01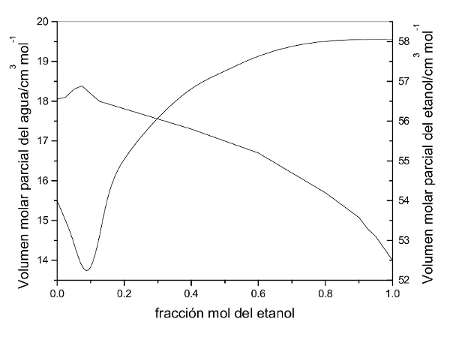 Ejemplo: Calcular la contracción de volumen de una disolución en la que hay presentes 4 moles de etanol y 6 moles de agua. La FM es 4/(4+6) = 0,4 Si en el valor 0,4 en el eje horizontal levantamos una línea vertical, vemos que corta a los VMP del etanol y del agua en los valores 57 y 17 (ml), de manera que podemos calcular el volumen de la disolución en esas condiciones: VD = 4 x 57 + 6 x 17 = 330 ml Para calcular el volumen que ocuparían esos moles de ambas sustancias antes de la mezcla, basta con mirar los extremos de las gráficas correspondientes y ver que son de 58 y pico para el etanol y de 18 para el agua, de manera que el volumen contado por separado sería VS = 4 x 58,4 + 6 x 18 = 341 ml. De manera que la contracción de volumen será CV = VD - VS = 330 - 341 = -11 ml, que contados sobre los 341 ml corresponden a un -3% aproximadamente, muy poco significativo. |
-La disolución de etanol en agua es un fenómeno ampliamente estudiado y muy bien documentado en la Red. No es difícil encontrar gráficas como la que se ve a la izquierda, en la que se representa (en vertical) los volúmenes molares parciales del agua y del etanol en función de la fracción molar del etanol (en horizontal) -El volumen molar parcial (VMP) es lo que ocupa cada mol de agua o etanol según la concentración de la disolución, medida como la fracción molar (FM) del etanol. El VMP se mide pues en ml/mol, y puede verse en la gráfica, por ejemplo, que el VMP del agua cuando no hay nada de etanol viene a ser de unos 18 gr/mol, tal como predice su peso molecular (H2O => 2x1+16=18). La FM es un factor adimensional que mide el tanto por uno (%/100) de moles de soluto presentes en la disolución. -El problema de los VMP es que no pueden calcularse más que de forma experimental. Tratándose de una propiedad coligativa intensiva, su estudio teórico es sencillamente inabordable, y hay que calcularlo mediante la obtención de datos experimentales y un tratamiento matemático posterior para su determinación (ajustes polinómicos, derivación gráfica,..) La gráfica adjunta está hecha de esa manera, tal como puede verse en este documento... (Física Química CIBEX, 2013) |
|
|
|
| 8.15.02 VMP_Sacarosa_Agua.xls |
-De la disolución de Sacarosa en agua no he encontrado en la red una gráfica como la del etanol-agua vista arriba. -Sin embargo, en una tesis de grado (Sánchez Henríquez, dic. 2005) se ha tocado este tema de una manera colateral, y de ahí he podido sacar algunos datos para construir la hoja de cálculo que adjunto. -En ella se han dispuesto los datos experimentales en las columnas 1-6, siendo el resto de columnas de elaboración propia. -Obsérvese que a pesar de ser alta la concentración en peso de la sacarosa (columna 3) su fracción molar es pequeña (columna 10) debido a su alto peso molecular. -La columna 19 me lleva a la conclusión de que la contracción de volumen producida por la sacarosa al disolverse en agua es muy poco significativa en los intervalos de concentración que usamos en la elaboración de cerveza, por lo que no tendría que ser tenida en cuenta en los cálculos de la densidad que de ello se deriven |
|
|
|
| 8.15.03 Dextrosa en Agua |
-De momento, no he sabido no encontrar nada similar para la disolución de Dextrosa en agua... si alguna vez tengo tiempo haré el desarrollo experimental para los VMP, de acuerdo con el procedimiento explicado en el documento CIBEX o en la Tesis de Grado... |
|
|
|